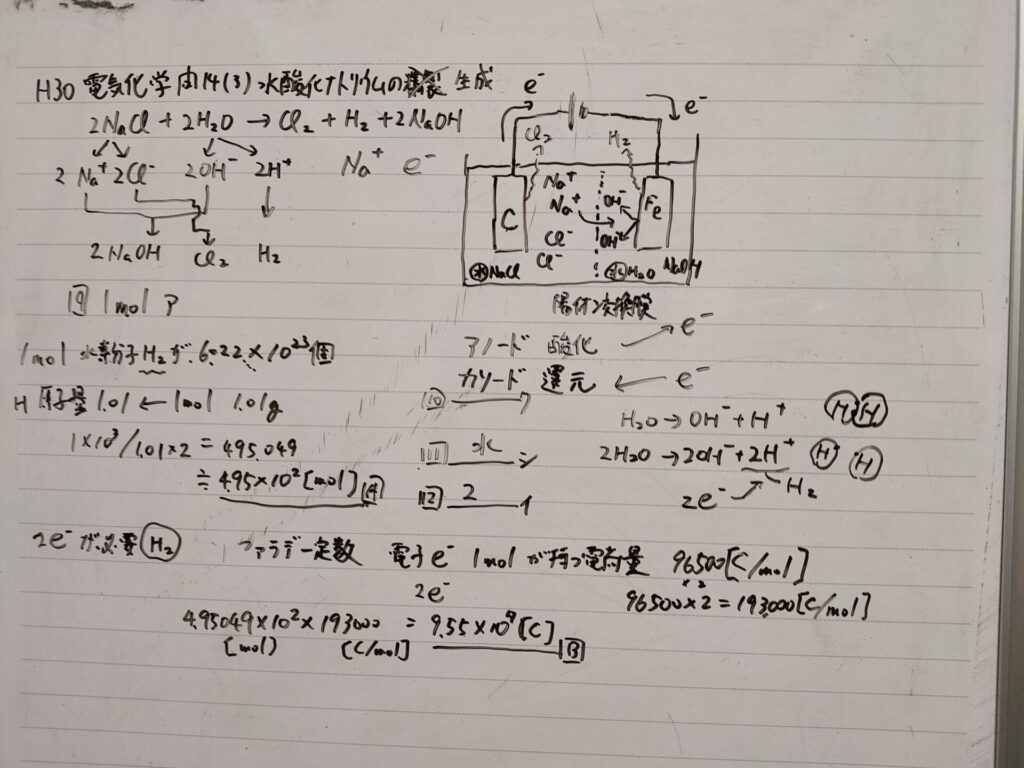
(3) 化学工業の基礎材料である塩素、水酸化ナトリウム(苛性ソーダ)は、次の反応式で表される食塩水の電気分解を利用して生成される。
\[2 NaCl + 2H_2O → Cl_2 + H_2 + 2NaOH\]
この反応で、\(1 mol\) の水酸化ナトリウムが生成されるのに必要な電子は、\(\fbox{9}[mol]\) である。 また、この反応では同時に水素も生成される。 水素は電解槽の中の\(\fbox{10}\)で\(\fbox{11}\)が還元されて生成されるが、\(1 mol\)の水素が生成されるのに必要な電子は\(\fbox{12}[mol]\) である。
ここで、\(Na\)の原子量が \(23.0\)、\(O\)の原子量が \(16.0\)、 \(H\)の原子量が \(1.01\) であり、ファラデー定数が\(96500[C/mol]\) であるとすると、水素\(1kg\) は、\(\fbox{A}[mol]\) であるので、水素 \(1kg\) を製造 するのに必要な理論電気量は、\(\fbox{B}[C]\)となる。
ア 1 イ 2 ウ 3 エ 4 オ 5 カ 6
キ アノード ク カソード ケ 塩化ナトリウム
コ 水酸化ナトリウム サ 電解質 シ 水

平成30年 電力応用問14(3) 水酸化ナトリウムの工業生成に関する問題 2018年エネルギー管理士課目4
工業的に広く用いられている水酸化ナトリウムは電気分解によって生成されることが多いです。そのため非常に多くの電気を使用していることからエネルギー管理士試験でも取り上げられる重要な項目です。エネルギー管理士過去問解説再生リスト

コメント